神经科学成果:星形胶质细胞的功能研究
|
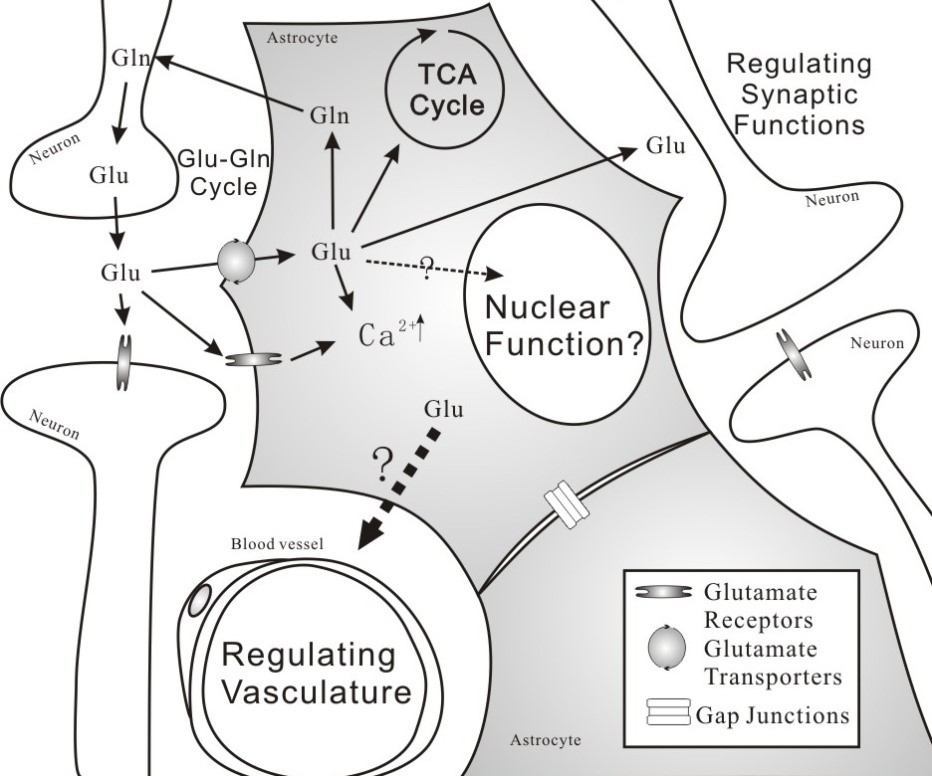
1. 星形胶质细胞与代谢性损伤 1) 谷氨酸-谷氨酰胺循环 (Glu-gln Cycle) 理论的纠正和完善。 很长一段时间内,神经科学界一直认为,神经系统内谷氨酸的代谢路径是:神经元释放出的谷氨酸进入星形胶质细胞,在其内全部转变成谷氨酰胺,然后回到神经元被利用。于常海通过实验发现了其中的难以解释的关键点,并纠正和完善了这个理论,通过实验结果证明:神经元释放出来的谷氨酸被星形胶质细胞摄取后,其代谢生成的谷氨酰胺,不仅有再回到神经元被利用的途径,还可经由星形胶质细胞线粒体途径代谢生成能量和二氧化碳。在此反应过程中,丙酮酸羧化酶在神经细胞的定位被首次确认,该结果发表在1982年的"Journal of Neurochemistry"上,其单篇引用达230次。 上述发现改变了对整个中枢神经系统代谢的认识,在神经生物界引起了很大的轰动,对于与中枢神经系统代谢相关的研究方向具有深远的意义。
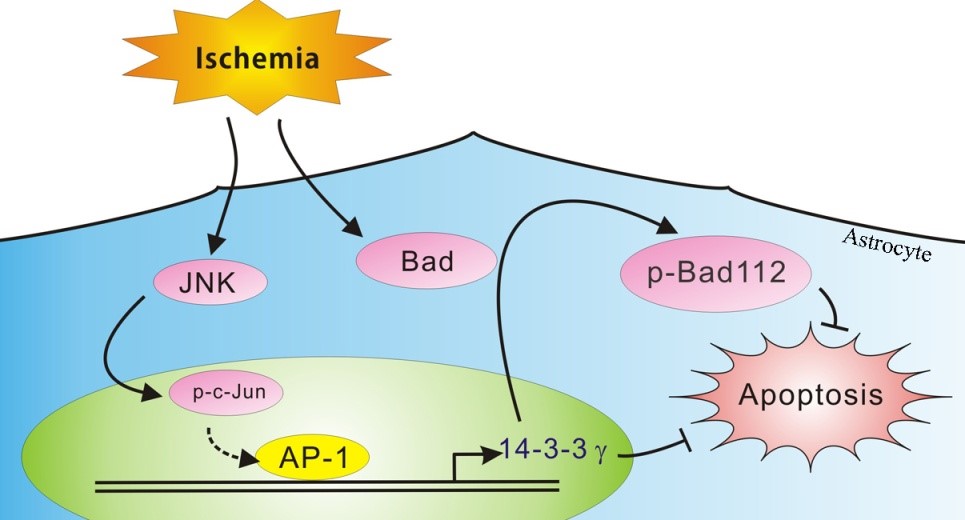
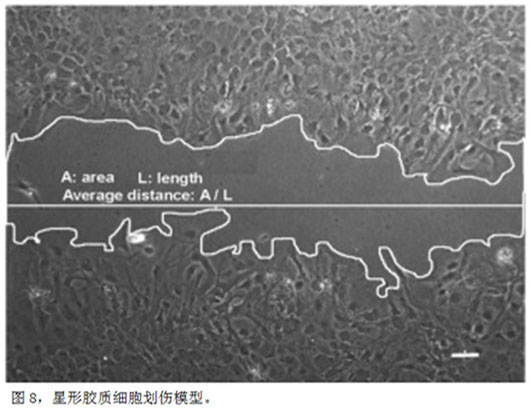
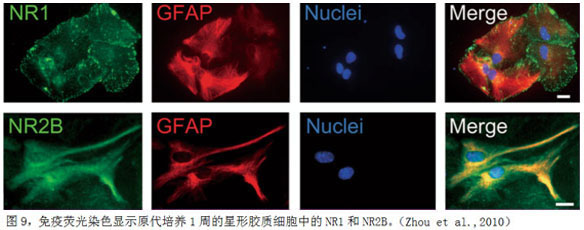
2) 谷氨酸引起星形胶质细胞核肿胀。 兴奋性神经递质谷氨酸介导了神经系统发育、突触信息传递、学习、疼痛和记忆等生理功能。病理条件下谷氨酸兴奋性神经毒性直接引起神经元损伤、神经元死亡及脑功能丧失等不良后果。细胞外谷氨酸主要由星形胶质细胞表面的谷氨酸转运蛋白吸收清除,并引起胶质细胞显著的胞体形态变化,表现为渐进性的胞体肿胀。于常海课题组近年研究显示,谷氨酸转运进入星形胶质细胞后,直接进入细胞核,并引起渐进性的细胞核肿胀。这种核肿胀独立于细胞肿胀的过程,依赖于细胞膜表面谷氨酸转运系统,但不需要细胞膜上谷氨酸受体、细胞内钙离子激活参与。水通道蛋白家族成员有表达定位于星形胶质细胞核膜表面,直接参与谷氨酸引起的细胞核肿胀过程。星形胶质细胞核肿胀直接引起细胞核功能改变,如c-fos,c-jun表达量改变,细胞核转录相关蛋白激活等,是星形胶质细胞特有功能反应,为胶质细胞功能研究提供另一新的方向。 3) 脑缺血预处理上调神经保护蛋白的机制研究。 作为内源性神经保护蛋白,14-3-3γ在缺血早期即被上调,促进了星形胶质细胞在缺血条件下的存活,抑制凋亡。 于常海研究组前期的工作发现了14-3-3γ可通过与112位磷酸化的Bad结合,阻止其进入线粒体从而抑制凋亡发生的途径 (Chen et al., 2005, J Cerebr Blood F Met)。之后,深入研究缺血损伤上调14-3-3γ这种内源性保护蛋白的机制,发现JNK/c-Jun/AP-1可能是在缺血早期参与神经细胞保护作用的重要信号转到通路 (Dong et al., 2009, Journal of Neurochemistry)。近期于常海研究组从缺血损伤中三种重要的因素:缺氧,缺糖,代谢性毒物累积对于14-3-3γ表达的影响入手,并阐明了三个不同因素对细胞损伤和14-3-3γ的升高发挥不同程度的作用。缺血时代谢产物glutamate可以加速14-3-3γ的上调。Glutamate的受体AMPAR和转运体transporters参与了14-3-3γ的上调的机制。14-3-3γ在缺血早期特异性表达上调,可能提示在缺血保护以及延长缺血治疗时间窗中可能发挥重要的作用。 2. 星形胶质细胞与物理性损伤 1992年于常海用星形胶质细胞创建了一个简单实用的模拟机械性损伤的划伤模型,开始研究星形胶质细胞激活的机制及细胞骨架的改变,成功用GFAP反义核苷酸抑制了星形胶质细胞在正常与划伤后GFAP的合成(Yu et al., 1993, J Neurosci Res),也用划伤模型证实了细胞因子在损伤后在星形胶质细胞内的合成和释放(Lau et al., Journal of Neurotrauma)。利用Quercetin成功抑制星形胶质细胞的激活(Wu et al., Journ al of Neurosci Res)。星形胶质细胞激活是大多数中枢神经系统损伤和疾病(包括缺血性脑损伤,机械损伤,神经退行性疾病以及衰老)过程中的一个明显的病理变化,其产生的胶质瘢痕会阻碍轴突的迁移和神经的修复。激活的星形胶质细胞会产生代谢和形态方面诸多变化,但星形胶质细胞激活的机制尚没有完全阐释清楚。激活的星形胶质细胞总伴随着细胞的肥大和迁移,以及GFAP的表达上调。本研究主要通过运用基于本实验室原创的原代培养星形胶质细胞的体外划伤模型来研究星形胶质细胞激活的机制。我们之前的研究发现,划伤刺激可以引起星形胶质细胞产生细胞内钙信号,钙信号以钙波的形式从划伤的细胞向划伤内侧传递,并进一步证明钙波的传递需要缝隙连接和P2受体的参与。在此基础上,我们通过运用钙信号的阻断剂 BAPTA-AM证实钙信号通过调控细胞肥大迁移和GFAP上调参与了星形胶质细胞激活的过程。在激活的星形胶质细胞中,巨胞饮可以促进细胞的肥大和迁移。而本研究证明钙信号介导了激活了PI3K,Raf-1,JNK 和p38等多条巨胞饮相关信号通路的激活,并且证实Raf-1是通过与微丝相互作用从而参与到巨胞饮过程中的。此外,我们还证明了钙信号激活的JNK可以激活其下游转录因子c-Jun,从而促进AP-1转录复合体结合到GFAP基因启动子区的活性,进而上调GFAP的转录水平(Gao et al., 2013, GLIA),GFAP骨架网络与其他细胞骨架网络和细胞-细胞外基质连接复合体相互作用参与细胞迁移。
3. 星形胶质细胞与疼痛 星形胶质细胞在慢性疼痛的维持中发挥重要作用。对于其参与慢些疼痛新机制的发现将有助于慢性疼痛的治疗。强啡肽原和强啡肽在持久的慢性疼痛中发挥重要作用。在于常海研究组的研究中,首次证实了强啡肽原及强啡肽在原代培养的星形胶质细胞中存在。在原代培养的星形胶质细胞中发现了强啡肽原的mRNA。使用放射免疫的方法,发现了强啡肽的主要剪切产物强啡肽A(1-13)在星形胶质细胞中有表达。DREAM(Downstream Regulatory Element Antagonist Modulator)作为强啡肽原基因转录调节因子参与疼痛调节。使用原代培养的星形胶质细胞和神经元研究DREAM发现星形胶质细胞中的DREAM以两种形式存在:一种分子量约30kD存在于细胞浆,另一种约120kD存在于细胞核,但是神经元中的DREAM蛋白只以30kD的形式存在于细胞浆。使用免疫组化及转染过表达的方法证实了DREAM在星形胶质细胞与神经元中的这一分布差异。使用疼痛相关物质:缓激肽、P物质和谷氨酸研究星形胶质细胞中DREAM和强啡肽原的功能,发现在这些物质处理条件下,星形胶质细胞与神经元的具有不同的反应。这些结果提示星形胶质细胞可以表达有功能的DREAM、强啡肽原和强啡肽,并且通过这些分子,星形胶质细胞以与神经元不同的方式参与慢性疼痛。 4. 星形胶质细胞中新蛋白的功能研究 脑发育早期,在神经营养因子调控下,约有一半以上的神经元发生凋亡。这种凋亡对于正常脑组织功能的形成非常重要。NDAP(神经发育相关蛋白)是于常海实验室发现并鉴定的一个新蛋白,研究表明其基因表达与神经元发育具有显著的相关性。其基因表达水平受BDNF,NT3和NGF等神经营养因子调控,并与发育中凋亡时相密切相关 (Li et al., 2006, FEBS Lett)。另外发现NDAP定位于内质网上,高表达的NDAP会引起内质网应激和凋亡。此外为进一步研究其功能我们还研制出针对NDAP的多克隆抗体,将以此进行对NDAP蛋白水平的一系列研究。 5. 星形胶质细胞中水通道蛋白的研究 水通道对脑内水分子的转运至关重要,星形胶质细胞是负责调整和维持脑内水分子平衡稳态的主要细胞,且在损伤和疾病导致的脑水肿中星形胶质细胞也是肿胀最为明显的细胞类型,理清星形胶质细胞中水通道表达、分布及它们在不同损伤中变化,对深入理解脑内水分子运动及脑水肿发生至关重要。如AQP1、AQP3、AQP4、AQP5、AQP8和AQP9已被报道在大鼠的脑内和星形胶质细胞中存在表达。在此基础上于常海实验室明确了AQP1、AQP4、AQP5和AQP9在小鼠星形胶质细胞中的表达。与AQP1、AQP4和AQP9在脑内众多功能已被揭示相比,虽然AQP5在中枢神经系统外的多种功能已被报道,但AQP5在脑内的研究几乎处于空白,前期的研究结果表明AQP5在小鼠原代培养的星形胶质细胞和神经元内均存在表达,且AQP5的mRNA和蛋白表达在1到4周原代培养的星形胶质细胞中均可检测出。目前已经一步明确了AQP5主要分布于星形胶质细胞的胞浆和胞膜上,且在胞膜的定位与AQP4存在差异。此外,AQP5在星形胶质细胞受到缺血损伤时会表达下调,而在星形胶质细胞受到划伤损伤时会表达上调,AQP5这种在不同损伤中的发生不同表达改变的表现,在体缺血性损伤模型-大鼠中动脉阻塞(middle cerebral artery occlusion, MCAO)模型和在体外伤性损伤模型-大鼠大脑皮层戳伤(stab-wound injury)模型中得到了确证。于常海实验室还发现,在星形胶质细胞受到划伤损伤后,升高的AQP5主要极化分布在处于划伤边缘的星形胶质细胞正在迁移的突起及其细胞膜上,且AQP5的过表达可以促进划伤边缘星形胶质细胞突起的伸长和生长。综上的结果表明,AQP5可能是星形胶质细胞内另外一个重要的水通道分子,并且它可通过不同的表达改变来参与星形胶质细胞对不同脑损伤应答(Chai et al., 2013, Glia)。
|